Биофилми су скуп једне или више врста микроорганизама који могу расти на различитим површинама. Микроорганизми који формирају биофилме укључују бактерије, гљивице и протисте.
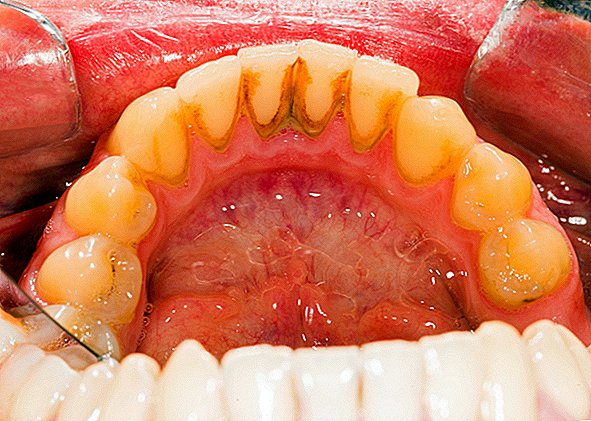
Један чест пример зубног плака на биофилму, гнојна накупина бактерија која се формира на површинама зуба. Лопа са рибњаком је још један пример. Пронађени су биофилми на минералима и металима. Пронађени су под водом, под земљом и изнад земље. Они могу расти на биљним ткивима и животињским ткивима, као и на имплантираним медицинским уређајима попут катетера и пејсмејкера.
Свака од ових карактеристичних површина има заједничко својство: мокро је. Ова окружења су „периодично или непрекидно натопљена водом“, према чланку из 2007. објављеном у часопису Мицробе Магазине. Биофилми успевају на влажним или влажним површинама.
Биофилми су се у таквим окружењима етаблирали веома дуго. Фосилни докази о биофилмовима датирају пре око 3,25 милијарди година, наводи се у чланку из 2004. објављеном у часопису Натуре Ревиевс Мицробиологи. На пример, биофилмови су пронађени у хидротермалним стијенама Пилбара Цратон у Аустралији, старим 3,2 милијарде година. Слични биофилми налазе се у хидротермалним окружењима попут врућих извора и отворених отворених мора.

Формирање биофилма
Формирање биофилма започиње када микроорганизми који слободно плутају, као што су бактерије, дођу у контакт с одговарајућом површином и почну да спуштају корење, да тако кажем. Први корак везивања настаје када микроорганизми производе гнојну супстанцу познату као ванћелијска полимерна супстанца (ЕПС), саопштено је из Центра за биофилм инжењеринг на Државном универзитету у Монтани. ЕПС је мрежа шећера, протеина и нуклеинских киселина (попут ДНК). Омогућује да се микроорганизми у биофилму лепе заједно.
Након везаности следи период раста. Даљњи слојеви микроорганизама и ЕПС надограђују се на првим слојевима. На крају, они стварају гомољасту и сложену 3Д структуру, према Центру за биофилм инжењеринг. Водени канали крижају биофилмове и омогућавају размену хранљивих материја и отпадних производа, наводи се у чланку Мицробе-а.
Вишеструки еколошки услови помажу у одређивању степена раста биофилма. Ови фактори такође одређују да ли је сачињен од само неколико слојева ћелија или значајно више. "То заиста зависи од биофилма", рекао је Робин Герлацх, професор на одсеку за хемијско и биолошко инжењерство на Државном универзитету у Монтани-Боземан. На пример, микроорганизми који производе велику количину ЕПС-а могу прерасти у прилично густе биофилмове чак и ако немају приступ пуно хранљивих материја, рекао је. С друге стране, за микроорганизме који зависе од кисеоника, расположива количина може ограничити њихов раст. Други околински фактор је концепт „смичног напрезања“. "Ако имате веома висок проток кроз биофилм, попут потока, биофилм је обично прилично танки. Ако имате биофилм у води која споро тече, попут баре, може постати веома густ", објаснио је Герлацх.
Коначно, ћелије унутар биофилма могу напустити набор и успоставити се на новој површини. Или се гомила ћелије одвоји, или се поједине ћелије распрсну из биофилма и потраже нови дом. Овај последњи поступак познат је као "распршивање семена", према Центру за биофилм инжењеринг.
Зашто формирати биофилм?
За микроорганизме, живот као део биофилма има одређене предности. "Заједнице микроба су обично отпорније на стрес", рекао је Герлацх за Ливе Сциенце. Потенцијални стресори укључују недостатак воде, висок или низак пХ или присуство супстанци токсичних за микроорганизме, попут антибиотика, антимикробних лекова или тешких метала.
Постоји много могућих објашњења за тврдоћу биофилма. На пример, танак ЕПС покров може да делује као заштитна баријера. Може вам помоћи у спречавању дехидрације или делује као штит против ултраљубичастог (УВ) светла. Такође, штетне материје попут антимикробних лекова, избељивача или метала се вежу или неутралишу када дођу у контакт са ЕПС-ом. Стога су разблажени у концентрацијама које нису смртоносне пре него што могу да дођу до различитих ћелија дубоко у биофилму, према чланку из Натуре Натуре Мицробиологи из 2004. године.
Ипак, могуће је да одређени антибиотици продре кроз ЕПС и прођу кроз слојеве биофилма. Овде се може играти још један заштитни механизам: присуство бактерија које физиолошки успавају. Да би функционисали добро, свим антибиотицима је потребан одређени ниво ћелијске активности. Дакле, ако су бактерије физиолошки успаване за почетак, нема много тога да се антибиотик поремети.
Други начин заштите од антибиотика је присуство посебних бактеријских ћелија познатих као "персистент". Такве бактерије се не деле и отпорне су на многе антибиотике. Према чланку из 2010. године објављеном у часопису Цолд Спринг Харбор Перспецтивес ин Биологи, "истраја" функционише стварајући супстанце које блокирају циљеве антибиотика.
Генерално, микроорганизми који живе заједно као биофилм имају користи од присуства различитих чланова заједнице. Герлацх је навео примјер аутотрофних и хетеротрофних микроорганизама који живе заједно у биофилмима. Аутотрофи, попут фотосинтетских бактерија или алги, могу да производе сопствену храну у облику органског материјала (који садржи угљеник), док хетеротрофи не могу да производе сопствену храну и захтевају спољне изворе угљеника. "У тим заједницама са више организама често се крижају са храном", рекао је.
Биофилми и ми
С обзиром на огроман спектар окружења у којима сусрећемо биофилмове, не чуди да они утичу на многе аспекте људског живота. Испод је неколико примера.

Здравље и болест
Како су током година напредовала истраживања, биофилми - бактеријски и гљивични - били су умешани у различита здравствена стања. У позиву за пријаву за доделу из 2002. године, Национални институти за здравство (НИХ) приметили су да биофилми представљају „преко 80 одсто микробних инфекција у телу“.
Биофилми могу расти на имплантираним медицинским уређајима попут протетских срчаних залистака, зглобне протетике, катетера и пејсмејкера. То заузврат води инфекцијама. Појава је први пут примећена 1980-их када су бактеријски биофилми пронађени на интравенским катетерима и пејсмејкерима. Такође је познато да бактеријски биофилми изазивају инфективни ендокардитис и упалу плућа код оних са цистичном фиброзом, према чланку из 2004. године, између осталих инфекција, у чланку Натуре Ревиевс Мицробиологи.
"Разлог због којег је стварање биофилма велики разлог за забринутост је тај што су унутар биофилма бактерије отпорније на антибиотике и друга важна дезинфекциона средства која бисте могли да употребите за контролу над њима", рекао је АЦ Матин, професор микробиологије и имунологије на Станфорду Универзитет. У ствари, у поређењу са слободно плутајућим бактеријама, оне које расту као биофилм могу бити и до 1.500 пута отпорније на антибиотике и друга биолошка и хемијска средства, према чланку Мицробе-а. Матин је резистентност на биофилм комбиновао са општим порастом резистенције на антибиотике међу бактеријама као "двоструко хватање" и главни изазов за лечење инфекција.
Гљивични биофилми такође могу изазвати инфекције растом на имплантираним уређајима. Врсте квасца, као што су припадници рода Цандида расту на имплантатима груди, пејсмејкерима и протетским срчаним залистацима према чланку из 2014. објављеном у часопису Цолд Спринг Харбор Перспецтивес ин Медицине. Цандида врсте такође расту на ткивима човека, што доводи до болести као што су вагинитис (упала вагине) и орофарингеална кандидијаза (инфекција квасца која се развија у устима или грлу). Међутим, аутори примећују да резистенција на лекове није приказана у тим случајевима.
Биоремедијација
Понекад су биофилми корисни. "Биоремедијација уопште је употреба живих организама или њихових производа - на пример ензима - за лечење или разградњу штетних једињења", рекао је Герлацх. Напоменуо је да се биофилми користе у пречишћавању отпадних вода, загађивача тешких метала попут хромата, експлозива попут ТНТ-а и радиоактивних супстанци попут урана. "Микроби их могу или деградирати, или променити мобилност или токсично стање и на тај начин их учинити мање штетнима за животну средину и људе", рекао је.
Нитрификација помоћу биофилма представља један облик обраде отпадних вода. Током нитрификације, амонијак се претвара у нитрите и нитрате оксидацијом. То могу учинити аутотрофичне бактерије, које расту као биофилми на пластичним површинама, наводи се у чланку из 2013. објављеном у часопису Ватер Ресеарцх. Те су пластичне површине величине само неколико центиметара и распоређене су кроз воду.
Експлозивни ТНТ (2,4,6-тринитротолуен) сматра се загађивачем тла, површинских вода и подземних вода. Хемијска структура ТНТ-а састоји се од бензена (шестерокутни ароматични прстен сачињен од шест атома угљеника) везаног на три нитро групе (НО2) и једна метил група (ЦХ3). Микроорганизми разграђују ТНТ редукцијом, наводи се у чланку из 2007. објављеном у часопису Апплиед анд Енвиронментал Мицробиологи. Већина микроорганизама смањује три нитро групе, док неки нападају ароматични прстен. Истраживачи - Аират Зигансхин, Робин Герлацх и његове колеге - открили су да квасац има сој Иарровиа липолитица био у стању да разгради ТНТ обе методе, мада превасходно нападајући ароматични прстен.
Микробне горивне ћелије
Микробне горивне ћелије користе бактерије за претварање органског отпада у електричну енергију. Микроби живе на површини електроде и преносе електроне на њу, стварајући на крају струју, рекао је Герлацх. Чланак из 2011. објављен у интернетском часопису Универзитета Јужна Калифорнија у Иллумин, примјећује да бактерије које напајају микробне горивне ћелије разграђују храну и телесни отпад. То обезбеђује јефтин извор енергије и чисту одрживу енергију.
У току истраживања
Наш свет обилује биофилмима. У ствари, до средине 20. века, више бактерија пронађено је на унутрашњим површинама посуда у којима се налазе бактеријске културе, него што слободно лебди у самој течној култури, према чланку из 2004. у часопису Натуре Ревиевс Мицробиологи. Разумевање ових сложених микробних структура је активно подручје истраживања.
"Биофилми су невероватне заједнице. Неки људи их упоређују са вишећелијским организмима јер постоји пуно интеракција између појединих ћелија", рекао је Герлацх. "Ми настављамо да учимо о њима и настављамо да учимо о томе како их боље контролисати; како за смањену штету, тако и за област медицине, или за већу корист као у биоремедијацији. Неће нам недостајати занимљива питања у тој области. "