Рани 20. век био је веома повољан период за науке. Поред тога што су Ернест Рутхерфорд и Ниелс Бохр родили Стандардни модел физике честица, био је то и период пробоја на пољу квантне механике. Захваљујући непрекидним студијама о понашању електрона, научници су почели да предлажу теорије по којима су се те елементарне честице понашале на начин који је пркосио класичној, њутонистичкој физици.
Један такав пример је модел електронског облака који је предложио Ервин Сцхродингер. Захваљујући овом моделу, електрони се више нису приказивали као честице које се крећу око централног језгра у фиксној орбити. Уместо тога, Сцхродингер је предложио модел по коме су научници могли само да стварају нагађања о позицији електрона. Стога се њихове локације могу описати само као део „облака“ око језгра у коме ће вероватно бити пронађени електрони.
Атомска физика 20. века:
Најранији познати примери атомске теорије потичу из древне Грчке и Индије, где су филозофи попут Демокрита постулирали да је сва материја састављена од сићушних, недељивих и неуништива. Израз "атом" скован је у древној Грчкој и покренуо је школу мисли која је позната као "атомизам". Међутим, ова теорија је била више филозофски концепт него научни.
Тек у 19. веку се теорија атома артикулирала као научна материја, спроведен је први експеримент на основу доказа. На пример, у раним 1800-има, енглески научник Јохн Далтон користио је концепт атома да објасни зашто су хемијски елементи реаговали на одређене видљиве и предвидљиве начине. Кроз низ експеримената са гасовима, Далтон је развио оно што је познато као Далтонова атомска теорија.
Та се теорија проширила на законима разговора маса и одређених пропорција и своди се на пет премиса: елементи се, у свом најчишћем стању, састоје од честица које се називају атоми; атоми одређеног елемента су сви исти, све до последњег атома; атоми различитих елемената могу се разликовати по атомској маси; атоми елемената уједињују се у хемијска једињења; атоми се не могу створити или уништити у хемијској реакцији, само се групирање увек мења.
Откривање електрона:
До краја 19. века, научници су такође почели да теоретишу да је атом сачињен од више основних јединица. Међутим, већина научника је схватила да ће та јединица бити величине најмањег познатог атома - водоника. До краја 19. века његово би се драстично променило захваљујући истраживањима научника попут сер Џозефа Џона Томсона.
Кроз низ експеримената помоћу катодних цеви (познатих као Цроокес-ова цев), Тхомсон је приметио да катодне зраке могу да се одбију електричним и магнетним пољем. Закључио је да су, уместо да буду сачињене од светлости, састављене од негативно набијених честица које су 1ооо пута мање и 1800 пута лакше од водоника.

Ово је ефикасно оповргло идеју да је атом водоника најмања јединица материје, а Тхомпсон је наставио да сугерира да су атоми дељиви. Да би објаснио укупни набој атома, који се састојао од позитивних и негативних наелектрисања, Тхомпсон је предложио модел по коме су негативно наелектрисани "лешеви" распоређени у јединственом мору позитивног набоја - познатом као модел пудинга од шљиве.
Ти би се труплаци касније именовали "електрони", на основу теоријске честице коју је 1874. предвидио англо-ирски физичар Георге Јохнстоне Стонеи. И из тога се родио Пудинг Плуминг модел, назван тако што је подсећао на енглеску пустињу која се састоји од торта од шљиве и грожђице. Концепт је представљен свету у марту 1904. Издању Велике Британије Филозофски магазин, широко одобравати.
Развој стандардног модела:
Накнадни експерименти открили су бројне научне проблеме са моделом пудинга од шљиве. За почетак је постојао проблем доказивања да атом поседује једнообразан позитивни набој који је постао познат под називом „Тхомсон проблем“. Пет година касније, модел ће оповргнути Ханс Геигер и Ернест Марсден, који су спровели низ експеримената користећи алфа честице и златну фолију - ака. експеримент „златне фолије“.
У овом експерименту, Геигер и Марсден су мерили схему распршивања алфа честица флуоресцентним екраном. Да је Тхомсон-ов модел тачан, алфа честице би несметано пролазиле кроз атомску структуру фолије. Међутим, напоменули су да су многи док су пуцали право кроз њих неки били разбацани у разним смеровима, а неки опет у правцу извора.

Геигер и Марсден су закључили да су честице наишле на електростатичку силу далеко већу од оне коју допушта Тхомсон-ов модел. Пошто су алфа честице само језгра хелија (која су позитивно наелектрисана), то је подразумевало да позитивни набој у атому није широко диспергован, већ концентрисан у малом волумену. Поред тога, чињеница да су оне честице које нису биле одбачене пролазиле несметано значило је да су ови позитивни простори били раздвојени огромним прорезима празног простора.
До 1911. физичар Ернест Рутхерфорд тумачио је Геигер-Марсденове експерименте и одбацио Тхомсон-ов модел атома. Уместо тога, предложио је модел где се атом састојао од углавном празног простора, са свим својим позитивним наелектрисањем концентрисаним у његовом центру у врло малом волумену, који је био окружен облаком електрона. Ово је постало познато као Рутхерфорд Модел атома.
Накнадни експерименти Антонија Ван ден Броека и Ниелса Бохра још су побољшали модел. Док је Ван ден Броек сугерисао да је атомски број елемента веома сличан његовом нуклеарном набоју, последњи је предложио модел атома из Сунчевог система, где језгро садржи атомски број позитивног набоја и окружен је једнаким број електрона у орбиталним љуштурама (ака Боров модел).
Модел електронског облака:
Током 1920-их аустријски физичар Ервин Сцхродингер очарао је теоријама Мак Планцк, Алберт Ајнштајн, Ниелс Бохр, Арнолд Соммерфелд и други физичари. За то време, такође се укључио у поља атомске теорије и спектра, истражујући на Универзитету у Цириху, а затим и на Универзитету Фриедрицха Вилхелма у Берлину (где је наследио Планка 1927.).

1926. Сцхродингер се у низу радова бавио проблемом таласних функција и електрона. Осим што је описао оно што ће постати познато као Сцхродингерова једначина - делимична диференцијална једначина која описује како се квантно стање квантног система мења с временом - користио је и математичке једнаџбе да би описао вероватноћу да се нађе неки електрон у одређеној позицији .
Ово је постало основа онога што ће постати познат под називом Електронски облак (или квантно механички) модел, као и Сцхродингерова једначина. На основу квантне теорије која каже да сва материја има својства повезана са таласном функцијом, модел електронског облака се разликује од Боровог модела по томе што не дефинише тачан пут електрона.
Уместо тога, предвиђа вероватни положај локације електрона на основу функције вероватноће. Функција вероватноће описује област налик облаку у којој ће се вероватно наћи електрон, отуда и име. Тамо где је облак најгушћи, вероватноћа проналаска електрона је највећа; а где је електрон мање вероватно, облак је мање густ.
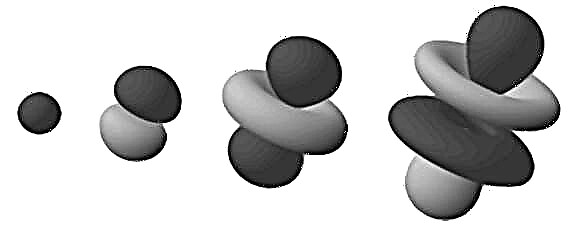
Ове густе регије познате су и као „електроне орбита“, пошто су највероватније место где ће се наћи орбитирани електрон. Проширивши овај модел „облака“ на тродимензионални простор, видимо атом мрене или цвета у облику цвета (као на слици на врху). Овде су разгранати региони они у којима највероватније налазимо електроне.
Захваљујући Сцхродингеровом раду, научници су почели да разумеју да је у подручју квантне механике немогуће истовремено знати тачну позицију и момент електрона. Без обзира на то што посматрач у почетку зна о честици, они могу само предвидјети њено успешно место или замах у смислу вероватноће.
Ни у једном тренутку неће моћи да утврде ниједан. У ствари, што више знају о моменту честице, мање ће знати о њеном положају и обрнуто. То је оно што је данас познато као "Начело несигурности".
Имајте на уму да су орбитале споменуте у претходном параграфу формиране атомом водоника (тј. Са само једним електроном). Када се бавимо атомима који имају више електрона, орбиталне области електрона равномерно се шире у сферну нејасну куглу. Овде је најприкладнији израз „облак електрона“.
Овај допринос је био универзално признат као један од трошковно важних доприноса 20. века и онај који је покренуо револуцију у областима физике, квантне механике и заиста свих наука. Од тада, научници више нису радили у универзуму који карактерише апсолути времена и простора, већ квантне несигурности и релативност времена и простора!
Овдје смо писали много занимљивих чланака о атомима и атомским моделима у часопису Спаце Магазине. Ево шта је Атомски модел Јохна Далтона ?, Шта је модел пудинга од шљиве ?, Који је Боров атомски модел ?, Ко је био Демокрит? И који су делови атома?
За више информација, проверите да ли је квантна механика? од Ливе Сциенце.
Астрономи Цаст такође има епизоду на ту тему, попут епизоде 130: Радио астрономија, епизода 138: квантна механика и епизода 252: Хеисенбергов принцип неизвесности